ข้อสอบ จร้าาาาาาาาาา
วันจันทร์ที่ 18 กันยายน พ.ศ. 2560
บทที่3
สมบัติของธาติหมู่ต่างๆ
ธาตุหมู่ I โลหะอัลคาไลน์ 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 1 2. มีเลขออกซิเดชัน +1
3. ทำปฏิกิริยาได้ดีมาก จึงไม่พบโลหะหมู่ I ในธรรมชาติ แต่จะพบในสารประกอบ สารประกอบทุกตัวเป็นพันธะไอออนิก 4. สารประกอบของโลหะหมู่ I ละลายน้ำได้ทุกตัว5. ทำปฏิกิริยารุนแรงกับน้ำ ได้ด้างและแก๊ส H2
6. ความหนาแน่นต่ำ ลอยน้ำได้ จุดเดือด จุดหลอมเหลว ไม่สูงนัก
1. มีเวเลนส์อิเล็กตรอนเท่ากับ 2 2. มีเลขออกซิเดชัน +2
3.ทำปฏิกิริยาได้ดี พบโลหะหมู่ II ในธรรมชาติและพบในรูปสารประกอบ สารประกอบส่วนใหญ่เป็นพันธะไอออนิก ยกเว้น Be
4. สารประกอบของโลหะหมู่ II ส่วนใหญ่ ละลายน้ำได้ดี แต่จะไม่ละลายน้ำถ้าเป็นสารประกอบของ CO32- SO42- PO43- ยกเว้น MgSO4
5. ทำปฏิกิริยากับน้ำ ได้ด่างและแก๊ส H2
ธาตุหมู่ VI ชาลโคเจน 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 6
2. มีเลขออกซิเดชันได้หลายค่า ตั้งแต่ -2 ถึง+6
3. จุดเดือด จุดหลอมเหลวสูงมากเมื่อเทียบกับหมู่VII ส่วนใหญ่เป็นสารประกอบประเภทโครงร่างตาข่าย
ธาตุหมู่ VII เฮโลเจน 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 7
2. มีเลขออกซิเดชันได้หลายค่า ตั้งแต่ -1 ถึง +7
3. เป็นธาตุหมู่เดียวที่1 โมเลกุล มี 2 อะตอมเรียกว่า Diatomic Molecule
4. พบเป็นธาตุอิสระในธรรมชาติ และพบในรูปของสารประกอบไอออนิกและโคเวเลนต์5. สารประกอบของหมู่ VII ส่วนใหญ่ละลายน้ำได้ดี ยกเว้นเป็นสารประกอบของ Ag Hg Pb
ธาตุหมู่ VIII แก๊สเฉื่อย , แก๊สมีตระกูล , Inert gas , Noble gas1. มีเวเลนส์อิเล็กตรอนเท่ากับ 8 ยกเว้น He มีเท่ากับ 22. มีเลขออกซิเดชันได้หลายค่า ตั้งแต่ -2 ถึง+6
3. จุดเดือด จุดหลอมเหลวสูงมากเมื่อเทียบกับหมู่VII ส่วนใหญ่เป็นสารประกอบประเภทโครงร่างตาข่าย
ธาตุหมู่ VII เฮโลเจน 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 7
2. มีเลขออกซิเดชันได้หลายค่า ตั้งแต่ -1 ถึง +7
3. เป็นธาตุหมู่เดียวที่1 โมเลกุล มี 2 อะตอมเรียกว่า Diatomic Molecule
4. พบเป็นธาตุอิสระในธรรมชาติ และพบในรูปของสารประกอบไอออนิกและโคเวเลนต์5. สารประกอบของหมู่ VII ส่วนใหญ่ละลายน้ำได้ดี ยกเว้นเป็นสารประกอบของ Ag Hg Pb
2. เฉื่อยชาต่อการเกิดปฏิกิริยามาก แต่สามารถสังเคราะห์ได้
3. มีค่า IE (Ionization Energy) สูงสุดในตาราง และ He มีค่า IE สูงที่สุดในตารางธาตุ 4. เป็นธาตุเดียวที่ไม่มีค่า EN

บทที่ 2
พันธะเคมี
ชนิดของพันธะเคมี
พันธะภายในโมเลกุล
(intramolecular bond) |
พันธะระหว่างโมเลกุล
(intermolecular bond) |
พันธะโคเวเลนต์ (covalent bonds)
|
พันธะไฮโดรเจน (hydrogen bonds)
|
พันธะไอออนิก (ionic bonds)
|
แรงแวนเดอร์วาลส์ (Van der Waals forces)
|
พันธะโลหะ ( metallic bonds)
|
แรงดึงดูดระหว่างโมเลกุล - ไอออน
(molecule-ion attractions) |
พันธะไอออนิก
พันธะไอออนิก ( Ionic bond ) หมายถึงแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมอะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก อะตอมที่มีค่าอิเลคโตรเนกาติวิตีน้อยจะให้อิเลคตรอนแก่อะตอมที่มีค่าอิเลคโตรเนกาติวิตีมาก และทำให้อิเล็กตรอนที่อยู่รอบๆ อะตอมครบ 8 (octat rule ) กลายเป็นไอออนบวก และไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น เช่น การเกิดสารประกอบ NaCl ดังภาพ
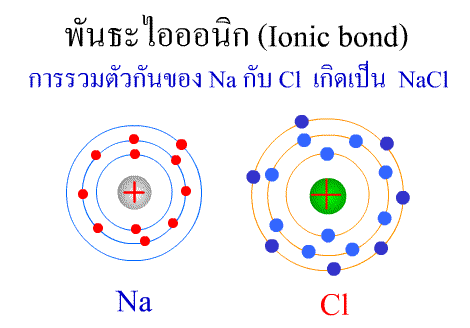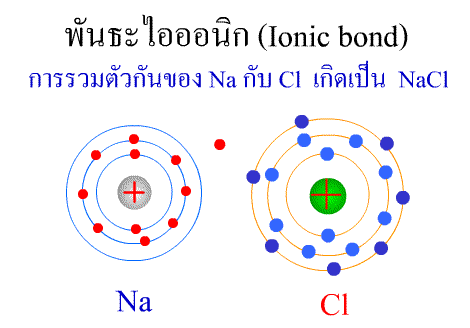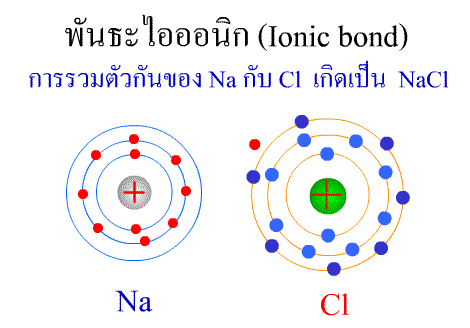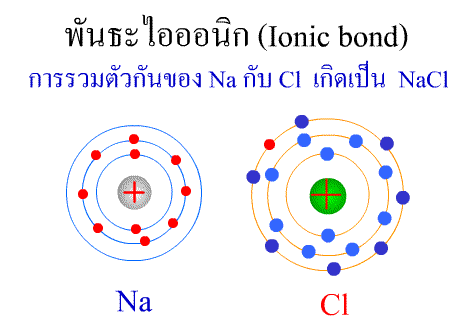
จากตัวอย่าง Na ซึ่งมีวาเลนซ์อิเล็กตรอนเท่ากับ 1 ได้ให้อิเล็กตรอนแก่ Cl ที่มีวาเลนซ์อิเล็กตรอนเท่ากับ 7 จึงทำให้ Na และ Cl มีวาเลนซ์อิเล็กตรอนเท่ากับ 8 เกิดเป็นสารประกอบไอออนิก
สมบัติของสารประกอบไอออนิก
1. มีขั้ว เพราะสารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมาก ซึ่งยึดเหนี่ยวกันด้วยแรงยึดเหนี่ยวทางไฟฟ้า
2. ไม่นำไฟฟ้าเมื่ออยู่ในสภาพของแข็ง แต่จะนำไฟฟ้าได้เมื่อใส่สารประกอบไอออนิกลงในน้ำ ไอออนจะแยกออกจากกัน ทำให้สารละลายนำไฟฟ้าในทำนองเดียวกันสารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วยเนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเลคตรอนทำให้อิเลคตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3 . มีจุหลอมเหลวและจุดเดือดสูง ความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวต้องใช้พลังงานสูง
4 . สารประกอบไอออนิกทำให้เกิดปฏิกิริยาไอออนิก คือ ปฏิกิริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฏิกิริยาจึงเกิดทันที
5 . สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6. เป็นผลึกแข็ง แต่เปราะและแตกง่าย
2. ไม่นำไฟฟ้าเมื่ออยู่ในสภาพของแข็ง แต่จะนำไฟฟ้าได้เมื่อใส่สารประกอบไอออนิกลงในน้ำ ไอออนจะแยกออกจากกัน ทำให้สารละลายนำไฟฟ้าในทำนองเดียวกันสารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วยเนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเลคตรอนทำให้อิเลคตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3 . มีจุหลอมเหลวและจุดเดือดสูง ความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวต้องใช้พลังงานสูง
4 . สารประกอบไอออนิกทำให้เกิดปฏิกิริยาไอออนิก คือ ปฏิกิริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฏิกิริยาจึงเกิดทันที
5 . สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6. เป็นผลึกแข็ง แต่เปราะและแตกง่าย
บทที่ 1
บทที่ 1
อะตอม คือหน่วยที่เล็กที่สุดของสสารที่ยังคงสภาพความเป็นสสารอยู่ได้
แบบจำลองอะตอม ตามทฤษฏี มีอยู่ 5 แบบ คือ
1. แบบจำลองอะตอมของดอลตัน
สสารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุดเรียกว่า อะตอม ซึ่งไม่สามารถแบ่งแยกต่อไปได้อีก
2. แบบจำลองอะตอมของทอมสัน
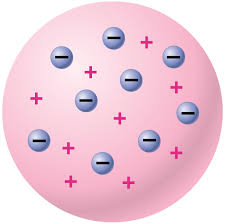
- ค้นพบอิเล็กตรอน ที่ มีประจุไฟฟ้าลบ มีมวลประมาณ1/2000 ของมวลของ H
- โดยศึกษาพฤติกรรมของ หลอดรังสีแคโทด ในสนามแม่เหล็กไฟฟ้า
3. แบบจำลองของรัทเทอร์ฟอร์ด
การกระเจิง (scattering) ของอนุภาค a โดยแผ่นทองคำบางๆ
รัทเทอร์ฟอร์ดพบว่ารังสีส่วนใหญ่ไม่เบี่ยงเบน และส่วนน้อยที่เบี่ยงเบนนั้น ทำมุมเบี่ยงเบนใหญ่มาก บางส่วนยังเบี่ยงเบนกลับทิศทางเดิมด้วย จำนวนรังสีที่เบี่ยงเบนจะมากขึ้นถ้าความหนาแน่นของแผ่นโลหะเพิ่มขึ้น
อนุภาคมูลฐาน
อนุภาค
|
ประจุ(หน่วย)
|
ประจุ(C)
|
มวล(g)
|
มวล(amu)
|
อิเล็กตรอน
|
-1
|
1.6 x 10-19
|
0.000549
|
9.1096 x 10-28
|
โปรตรอน
|
+1
|
1.6 x 10-19
|
1.007277
|
1.6726 x 10-24
|
นิวตรอน
|
0
|
0
|
1.008665
|
1.6749 x 10-24
|
การเขียนสัญลักษณ์นิวเคลียร์
AZX : เลขมวล คือผลบวกของโปรตอน และนิวตรอนในนิวเคลียส
เลขอะตอม คือ จำนวนโปรตอนในนิวเคลียส ซึ่ง =จำนวนอิเล็กตรอนในอะตอม
ตัวอย่าง การเขียนสัญลักษณ์นิวเคลียร์
ดังนั้น อะตอมของธาตุLithium ( Li ) มีจำนวนโปรตอน = 3 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
คำศัพท์ที่ควรทราบ
1. ไอโซโทป ( Isotope )
หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน
2. ไอโซบาร์ ( Isobar )
หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน
3. ไอโซโทน ( Isotone )
หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน
4. แบบจำลองอะตอมของนีลส์โบร์
นักวิทยาศาสตร์จึงมีการศึกษาข้อมูลใหม่มาสร้างแบบจำลองที่เน้นรายละเอียดเกี่ยวกับการจัดเรียงอิเล็กตรอนที่อยู่รอบนิวเคลียส โดยศึกษาจากสเปกตรัมและค่าพลังงานไอออไนเซชัน
สเปกตรัม
สเปกตรัมเป็นแสงที่ถูกแยกกระจายออกเป็นแถบสีต่าง ๆ และแสงเป็นรูปหนึ่งของคลื่นแม่เหล็กไฟฟ้า
แถบสีต่างๆในแถบสเปคตรัมของแสง
สเปกตรัม
|
ความยาวคลื่น (nm)
|
ม่วงน้ำเงินเขียวเหลืองส้มแดง
|
400 - 420420 - 490490 - 580580 - 590590 - 650650 - 700
|
สเปกตรัมของธาตุ
แมกซ์ พลังค์ได้เสนอทฤษฎีควอนตัม (quantum theory) และอธิบายเกี่ยวกับการเปล่งรังสีว่า รังสีแม่เหล็กไฟฟ้าที่เปล่งออกมามีลักษณะเป็นกลุ่มๆ ซึ่งประกอบด้วยหน่วยเล็กๆ เรียกว่า ควอนตัม (quantum) ขนาดของควอนตัมขึ้นกับความถี่ของรังสี และแต่ละควอนตัมมีพลังงาน (E) โดยที่ E เป็นปฏิภาคโดยตรงกับความถี่ (u) ดังนี้
E=hν
E = พลังงาน 1 ควอนตัมแสง(J)
h = ค่าคงที่ของพลังค์ (6.62x10-34 Js)
ν= ค่าความถี่ ( s-1)
5.แบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดีแต่ ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้จึงได้มีการศึกษาเพิ่มเติมจนได้แบบจำลองใหม่ที่เรียกว่ากลุ่มหมอก
สมัครสมาชิก:
ความคิดเห็น (Atom)
-
บทที่ 1 อะตอม คือหน่วยที่เล็กที่สุดของสสารที่ยังคงสภาพความเป็นสสารอยู่ได้ แบบจำลองอะตอม ตามทฤษฏี มีอยู่ 5 แบบ คื...
-
สมบัติของธาติหมู่ต่างๆ ธาตุหมู่ I โลหะอัลคาไลน์ 1. มีเวเลนส์อิเล็กตรอนเท่ากับ 1 2. มีเลขออกซิเดชัน +1 3. ทำปฏิกิริยาได้ดีมา...
